Stimulanzien - Analytik
Nichtkonjugiert ausgeschiedene wenig polare Stimulanzien

Diese Bestimmungsmethode wurde im wesentlichen bereits für die Olympischen Spiele in München 1972 entwickelt [1] . Hierbei werden Stimulanzien aber auch Narkotika erfasst, die "frei" (ungebunden) in den Urin ausgeschieden werden und underivatisiert gaschromatographiert werden können [2].
Bei diesen Verbindungen handelt es sich in der Regel um basische bzw. neutrale Substanzen, die direkt aus dem Urin unter alkalischen Bedingungen mit einem organischen Lösungsmittel, das sich nicht mit Wasser mischt (z.B. Diethylether oder tert.Butylmethylether), extrahiert werden. Ein geringer Anteil (2-3 µl) der Etherphase wird dann direkt auf die gaschromatographische Trennsäule injiziert.
Abb.3A zeigt das Gaschromatogramm eines Standardgemisches von Stimulanzien, wobei mit einem stickstoff-, phosphorspezifischen Flammenionisationsdetektor (NP-FID) analysiert wurde. Abb.3B demonstriert ein typisches Chromatogramm eines Urinextraktes, wobei nur Coffein (11), das in fast allen Urinproben auffindbar ist, und ein verwendeter Interner Standard (12) (N-dodecyl-N,N-diisopropylamin) angezeigt werden. Ein positiver Amphetaminfall ist in Abb.3C wiedergegeben, wobei ein deutliches Signal (2) mit der Retentionszeit von Amphetamin registriert wird.
GC/NP-FID-Chromatogramm zur eindeutigen Identifizierung
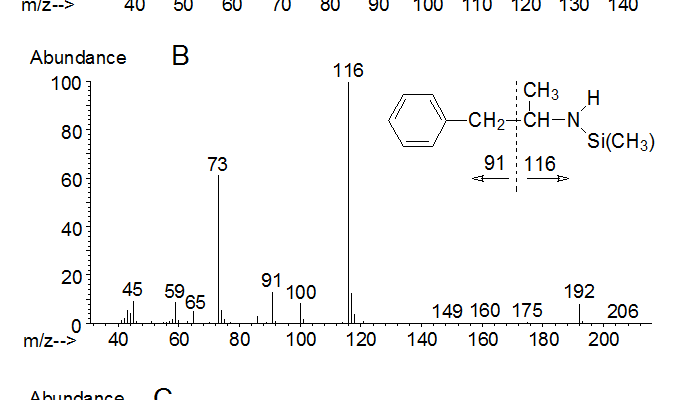
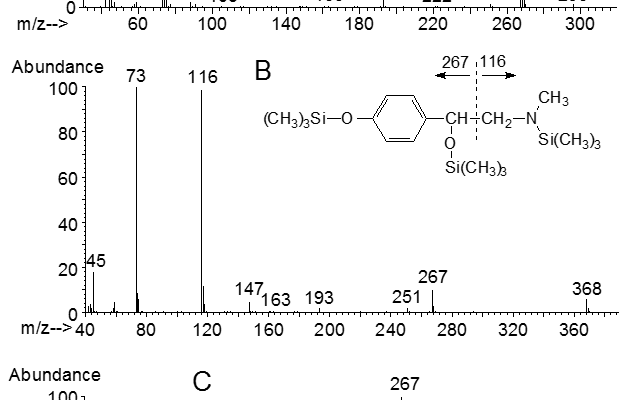
Zur eindeutigen Identifizierung der Substanz (2) in Abb.3C reicht das GC/NP-FID-Chromatogramm nicht aus. Hier muss die massenspektrometrische Identifikation erfolgen. Abb.4A zeigt das Massenspektrum von Amphetamin nach Elektronenstoßionisation mit 70 eVolt, wobei die Intensität des Molekülions m/z 135 deutlich niedriger als 1% des Basispeaks ist. Das Spektrum wird nach einer alpha-Spaltung zum Stickstoff (Abb.4a) vom Fragment m/z 44 (Basispeak) dominiert.
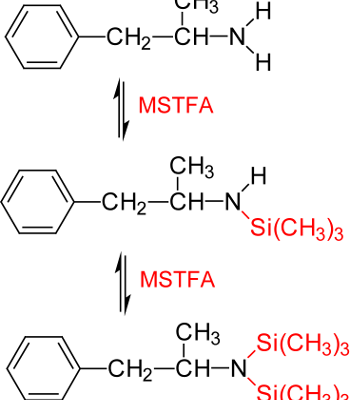
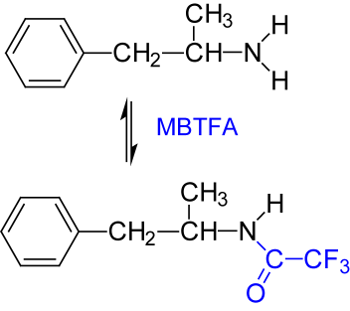
Um intensivere und aussagekräftigere Fragmente im höheren Massenbereich zu erhalten, kann Amphetamin derivatisiert werden, wobei eine Trimethylsilylierung mit N-Methyl-N-trimethylsilyltrifluoracetamid (MSTFA) (Abb.5 und Massenspektrum des Amphetamin-TMS in Abb.4B) bzw. mit Trifluoressigsäureanhydrid oder N-Methyl-bis-trifluoracetamid (MBTFA) erfolgen kann (Abb.6 und Massenspektrum in Abb.4C).
Chemische Derivate in der Doping-Analytik
Die Möglichkeit chemische Derivate zu bilden, wird in der Regel benutzt, wenn 1. die Substanz schlechte chromatographische Eigenschaften hat, 2. wenn charakteristische Ionen im niedrigen Massenbereich durch den von der biologischen Matrix erzeugten Untergrund extrem gestört werden (die Massenspektren werden durch die Derivatisierung zu Gunsten höhere Fragmentierungen verändert und erlauben somit eine eindeutigere Identifizierung der Verbindung), und 3. wenn eine Koelution mit einer anderen störenden Verbindung vorliegt und diese nicht durch die Probenvorbereitung bzw. durch die Verwendung einer anderen chromatographische Trennsäule abgetrennt werden kann.
Eines der am meisten verwendeten Derivatisierungsreagienzen für die gas-chromatographische Spurenanalyse ist N-Methyl-N-trimethylsilyl-trifluoracetamid (MSTFA), das erstmals 1969 von Manfred Donike [3] synthetisiert wurde.
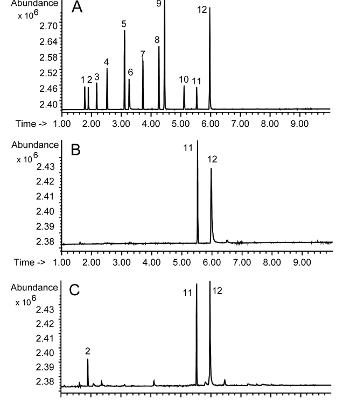
Abb.3 GC/NP-FID-Chromatogramme der Screeningmethode für flüchtige Stimulan-zien: A) Standardgemisch mit Heptaminol (1), Amphetamin (2), Metamphetamin (3), Dimetamphetamin (4), Nikotin (5), Ephedrin (6), Phenmetrazin (7), Niketamid (8), Pentetrazol (9), Fencamfamin (10), 1-(N,N-Diisopropyl)-dodecylamin (Interner Standard) (11) und Coffein (12); B) Urinextrakt mit Coffein (12) und internem Standard (11) und C) Urinextrakt einer mit Amphetamin (2) positiven Probe. Gerätebedingungen: Gerät: Hewlett-Packard MS 5971/GC 5890, Säule: Hewlett-Packard, HP1, 17m, I.D. 0.2mm, Filmdicke 0.11µm, Trägergas: Helium 1 ml/min split 1:20, Temperaturprogramm: 100°C - 20°C/min - 320°C.
Massenspektren der Verbindunge 1-12 nach Elektronenstoß-Ionisation (EI)
siehe Massenspektren (Beispiele)
Abb.5 Derivatisierung: Trimethylsilylierung von Amphetamin mit MSTFA zum Amphetamin-TMS und Amphetamin-bis-TMS. (Anmerkung: Unter gaschromatographischen Bedingungen ergibt sich in der Regel ein Gemisch der obigen Derivate in Abhängigkeit von der Aktivität der GC-Säule, wobei Amphetamin-TMS als Hauptprodukt registriert wird)
Konjugiert ausgeschiedene und/oder stark polare Stimulanzien und Narkotika
Mit dieser Methode werden zum einen Dopingsubstanzen erfasst, die als Konjugate (an Schwefelsäure bzw. Glucuronsäure gebunden) ausgeschieden werden, und zum anderen Substanzen, die aufgrund stark polarer Eigenschaften schlecht bzw. nicht gaschromatographisch analysiert werden können. Die Methode beinhaltet deshalb im Vergleich zu der vorhergehenden Methodik eine Hydroyse der Schwefelsäure- bzw. Glucuronsäure-Konjugate sowie eine Derivatisierung der polaren Gruppierungen.
Umsetzung mit Derivatisierungsreagenz MSTFA
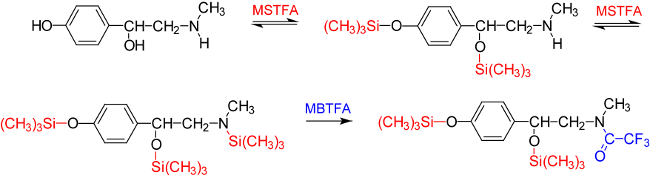
Hierbei erfolgt nach Donike [4] eine Umsetzung mit dem Derivatisierungsreagenz MSTFA (dargestellt am Beispiel der Silylierung von Synephrin in Abb.7, wobei sowohl ein bis-O-TMS-Derivat, Massenspektrum in Abb.8A, als auch ein bis-O-TMS-N-TMS-Derivat, Massenspektrum in Abb.8B, registriert werden kann), bzw. eine selektive Derivatisierung, wobei nach der Trimethylsilylierung eine Trifluoracetylierung der Aminfunktion mit N-Methyl-bis-trifluoracetamid (MBTFA) folgt (siehe Abb.7 und Massenspektrum in Abb.8C) und ein bis-O-TMS-N-TFA-Derivat quantitativ gebildetet wird.
Literatur
[1] Donike M, Jaenicke L, Stratmann D, Hollmann W: Gas-chromatographischer Nachweis von stickstoffahltigen Pharmaka in wässrigen Lösungen mit dem Stickstoffdetektor. J Chromatogr, 52 (1970) 237.
[2] Hemmersbach P, de la Torre R: Stimulants, narcotics and beta-blockers: 25 years of development in analytical techniques for doping control.J.Chromatogr B Biomed Appl, 687 (1996) 221 38. Review.
[3] Donike M: N-Methyl-N-trimethylsilyl-trifluoracetamid, ein neues Silylierungsmittel aus der Reihe der silylierten Amide. J Chromatogr, 42 (1969) 103.
[4] Donike M: Acylierung mit Bis(Acylamiden): N-Methyl-bis(trifluoracetamid) und Bis(trifluoracetamid), zwei neue Reagenzien zurTrifluoracetylierung. J Chromatogr, 78 (1973) 273.