Massenspektrometrie

Im Folgenden wird die Massenspektrometrie mit der Elektronenstoß-Ionisation beschrieben, wie sie in Verbindung mit der Gaschromatographie betrieben wird. Die Massenspektrometrie ist eine Analysetechnik zur Bestimmung von Molekülmassen.
Beispiel: Wasser ist ein Molekül mit der Masse 18, es besteht aus einem Atom Sauerstoff mit der Masse 16 und zwei Wasserstoffatomen mit der Masse von jeweils 1. In diesem Fall würde das Analysengerät die Masse 18 registrieren. Siehe auch Massenspektrum von Wasser weiter unten.
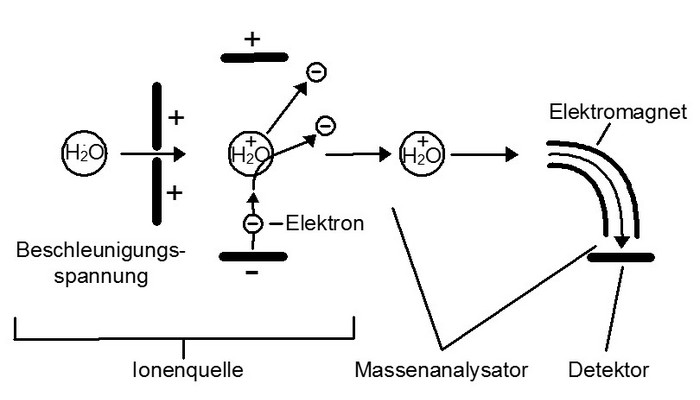
Ein Massenspektrometer besteht aus einer Ionenquelle, in der die gasförmigen Moleküle ionisiert werden, einem Massenanalysator, der die Ionen hinsichtlich ihres Masse/Ladungszahl-Verhältnisses (m/z) auftrennt, und einem Detektor, der die Intensität der erzeugten Ionen misst (Abb.2).
Als Ergebnis der Analyse wird ein Massenspektrum erstellt, aus dem hervorgeht, welche Ionen in welchen relativen Mengen zueinander gebildet worden sind.
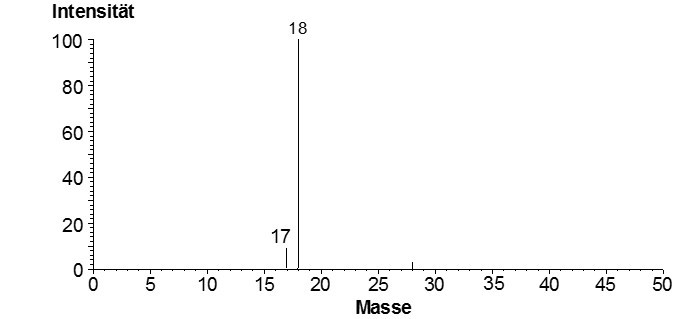
EI-Massenspektrum von Wasser (Abb.3)
Das gebildete Wasserion mit der Masse 18 ist sehr stabil und ist das intensivste Ion. Die Intensität des am stärksten gebildeten Ions wird dabei zu 100% gesetzt. Bei etwa 10% der entstandenen Ionen wird ein Wasserstoffatom abgespalten und es entsteht ein Ionenfragment mit der Masse 17.
Die Intensitätsskala gibt die relative Intensität eines Ions zum Ion mit der höchsten Intensität an. Die Massenskala (Masse/Ladung) gibt die jeweilige Masse des registrierten Ions an.
Für die Ionisierung der Moleküle stehen verschiedene Techniken zur Verfügung.
So wird z.B. bei der Elektronenstoß-Ionisation (EI) in Verbindung mit der Gaschromatographie das getrennte Molekül mit Elektronen beschossen. Unter dem Elektronenbeschuss wird ein Molekül positiv ionisiert, da ein Elektron aus seiner äußeren Schale entfernt wird.
Beispiel: Ein Wassermolekül wird zu einem positiven Ion (M+) mit der Masse 18 ionisiert.
Korrekterweise muss man hierbei aber von einem Radikalkation sprechen und die korrekte Schreibweise wäre [H2O]+•.
"Durch Entfernen eines Elektrons aus einem Molekül erhält man das Molekülion M+. Dieses enthält ein ungepaartes Elektronen und besitzt somit Radikalcharakter, was oft durch die Schreibweise M+• angedeutet wird; dabei steht der Punkt für das ungepaarte Elektron. Radikalkationische Melekülionen sind typisch für die Elektronenionisation (EI), wenngleich das Signal der M+•-Ionen auch fehlen kann." (Herbert Budzikiewicz, Mathias Schäfer. Massenspektrometrie. 6.Auflage, S.53, Wiley-VCH Verlag, Weinheim, 2012)

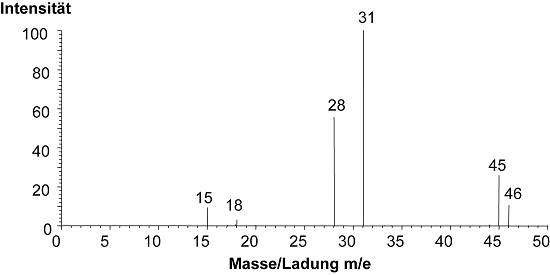
EI-Massenspektrum von Ethanol (Abb.5)
Beispiel: Ein Ethanolmolekül wird zu einem Molekülion M+ mit der Masse 46 ionisiert.
Die korrekte Struktur und Schreibweise des radikalkationischen Molekülions wäre [CH3-CH2-OH]+•.
Unter dem Elektronenbeschuss nimmt ein Molekül Energie auf, es wird dabei nicht nur ionisiert, sondern kann entsprechend seinem Aufbau auch fragmentieren, wobei es in weitere stabilere Fragmentionen zerfällt. Das Muster dieser Fragmentierung (Massenspektrum) ist für jedes Molekül charakteristisch und kann gewissermaßen als 'Fingerprint' einer Verbindung angesehen werden.
Das Massenspektrum von Ethanol (Abb.5) zeigt charakteristische Ionenfragmente mit m/e 28 (Abspaltung von Wasser), m/e 31 (Abspaltung einer Methylgruppe CH3) und m/e 45 (Abspaltung eines Wasserstoffatoms).
In der Dopinganalytik wurde bis Ende der 90er Jahre die Massenspektrometrie in der Regel mit einem vorgeschalteten Gaschromatographen (GC) betrieben. Heutzutage werden neben der GC zunehmend Flüssigkeitschromatographen(LC = liquid chromatograph) als Trennsysteme eingesetzt.
Weitere Infos zur Massenspektrometrie (MS):
Analytik/Stimulanzien
Analytik/Anabolika-Metandienon
29.8.2013