Insulin - Struktur, Doping und Nachweis
Struktur und Physiologie
Insulin ist ein köpereigenes Polypeptid, welches aus zwei Peptid-Ketten besteht, die über Disulfidbrücken verbunden sind. Die A-Kette besteht aus 21 Aminosäuren und die B-Kette aus 30 Aminosäuren (Heterodimer). Der schematische Aufbau des Moleküls ist in Abb. 1 dargestellt.
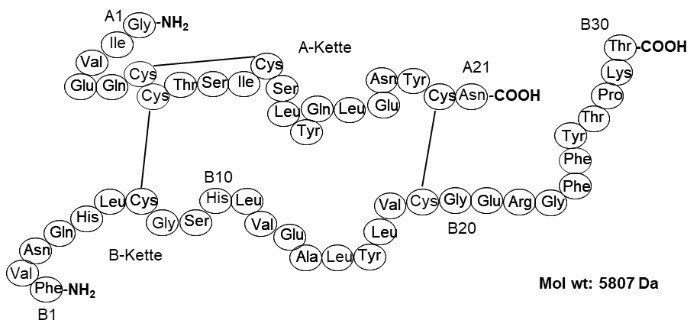
(Abkürzungen zu Abb.1 siehe Aminosäuren)
Das mittlere Molekulargewicht beträgt 5807 Da und der isoelektrische Punkt liegt bei etwa 5,3. Insulin wird in den β-Zellen der Langerhans`schen Inseln in der Bauchspeicheldrüse über ein Vorläuferpeptid (Proinsulin, bestehend aus Insulin und C-Peptid) produziert und zusammen mit C-Peptid in den Blutkreislauf sezerniert. [1]
Dort ist es im Wesentlichen für die Regulation des Blutzuckerspiegels verantwortlich. Die Isolierung und Charakterisierung von Insulin zu Beginn/Mitte des 20. Jahrhunderts gilt häufig als Geburtsstunde der Peptid- bzw. Proteinchemie und viele Erkenntnisse basieren auf diesen Forschungen (u. a. Nobelpreise Chemie/Medizin 1923, 1958 und 1964). Heutzutage hat Insulin eine große Bedeutung für die Behandlung von Diabetes mellitus (Zuckerkrankheit), und neben rekombinant humanem Insulin, sind einige synthetische schnell- oder langwirksame Insulinanaloga erhältlich. [1]
Doping
Der Missbrauch von Insulin als Dopingsubstanz hingegen stellt ein Phänomen dar, was erst gegen Ende des 20. Jahrhundert erkannt wurde. [2] Seit 1999 ist es dann auf die Liste der verbotenen Substanzen gesetzt worden und seit 2013 ist es unter der Kategorie S4 Metabolische Modulatoren aufgeführt. Während es therapeutisch zur Behandlung von Diabetikern eingesetzt wird, sind es vornehmlich die Anti-katabolen und lipolytischen Effekte sowie die Auffüllung der Glykogenreserven, die als leistungssteigernde Wirkungen von Insulin und seinen synthetischen Analogen diskutiert werden. [2] Dabei wird eine kombinierte Applikation von Insulin, Wachstumshormonen und anabolen Steroiden als besonders wirksam beschrieben. [2] Im Gegensatz zu vielen anderen Dopingsubstanzen birgt Insulin und seine Analoga jedoch gerade bei missbräuchlicher Verwendung von gesunden (nicht diabetischen) Sportlern die Gefahr einer akuten Hypoglykämie (Unterzuckerung) mit lebensbedrohlichen Folgen.
Nachweis
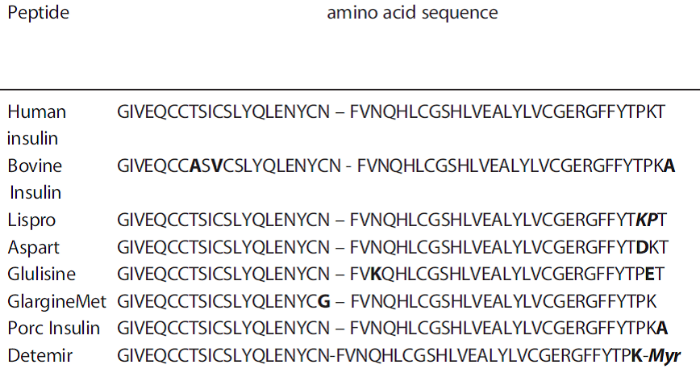
Analytisch stellt besonders die Unterscheidung der einzelnen synthetischen und tierischen Insuline eine Herausforderung dar, die sich strukturell nur durch den Austausch bzw. Tausch der Reihenfolge von einzelnen Aminosäuren unterscheiden (siehe Tab. 1). Die eindeutige Identifizierung und Unterscheidung vom endogen produzierten Humaninsulin ist hierbei der entscheidende Faktor.
(Abkürzungen zu Tab.1 siehe Aminosäuren)
Hierzu wurden im Vorfeld bereits ausführliche massenspektrometrische Studien durchgeführt, die eine eindeutige Identifizierung ermöglichen. Abb. 2 zeigt die Produktionenspektren von verschiedenen Applikationsstudien mit a) dem schnellwirkenden Insulinanalogen Lispro (Humalog) zugegeben an der Nachweisgrenze von ca. 5 pg/mL , b) Insulin Lispro (Humalog) nach Applikation, c) Insulin Aspart (Novolog) nach Applikation und d) Insulin Degludec (Tresiba) nach Applikation.
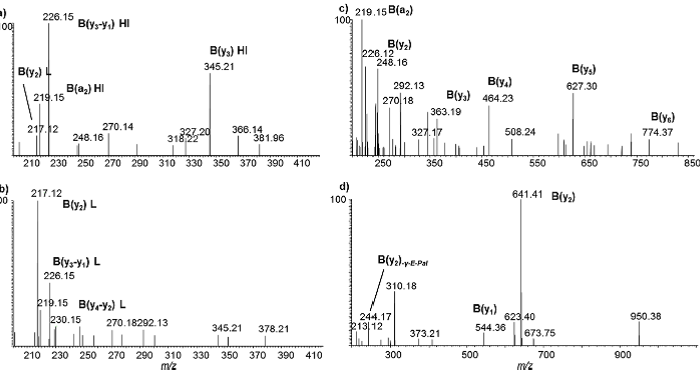
Die in den Spektren gezeigten Produktionen (benannt als y- bzw. b-Ionen) sind diagnostisch für das jeweilige synthetische Insulin und bestätigen eindeutig das Vorhandensein des verbotenen synthetischen Insulins auch in Gegenwart von Humaninsulin unter Berücksichtigung der vorgegeben Kriterien der WADA. Der Nachweis der verschiedenen Insuline ist prinzipiell aus verschiedenen Matrices (Urin, Serum, Plasma, etc.) möglich und beruht auf einer Antikörper-basierten Aufreinigung der Proben, flüssigkeitschromatographischer Trennung der Analyten und anschließender Detektion über hochauflösende Massenspektrometrie. Hiermit können derzeit alle zugelassenen Insuline (Lispro, Aspart, Glulisine, Glargine, Detemir, Degludec, Schweine- und Rinderinsulin) simultan und in hoher Empfindlichkeit erfasst werden. Weiterhin gibt es vielversprechende Ansätze die Verwendung von rekombinant humanem Insulin, welches chemisch dem köpereigenen entspricht, nachzuweisen. [5] Hierbei wird unter anderem das Verhältnis zum equimolar sezernierten C-Peptid berücksichtigt. Die Nachweismethode für Insuline erlaubt darüber hinaus auch die simultane Bestimmung von weiteren verbotenen Peptiden > 2 kDa (e.g. Growth hormone releasing hormones). [4] Weitere umfassende Informationen zu diesem Thema sind auch unter [6] zu finden.
(25.2.2018 Andreas Thomas)
Literatur
1) Löffler G, Petrides PE, Heinrich PC. Biochemie und Pathobiochemie, 8.Aufl. 2007, Springer, ISBN-10 3-540-32680-4
3) Thomas A, Schänzer W, Thevis M. Determination of human insulin and its analogues in human blood using liquid chromatography coupled to ion mobility mass spectrometry (LC-IM-MS). Drug Test Anal. 2014 Nov-Dec; 6(11-12):1125-32
siehe Abstract
4) Thomas A, Walpurgis K, Tretzel L, Brinkkötter P, Fichant E, Delahaut P, Schänzer W, Thevis M. Expanded test method for peptides >2 kDa employing immunoaffinity purification and LC-HRMS/MS. Drug Test Anal. 2015 Nov-Dec; 7(11-12):990-8
siehe Abstract
5) Thomas A, Brinkkötter P, Schänzer W, Thevis M. Metabolism of human insulin after subcutaneous administration: A possible means to uncover insulin misuse. Anal Chim Acta. 2015 Oct 15; 897:53-61
siehe Abstract
6) Identifizierung und Bestimmung von Humaninsulin, synthetischen Insulinanalogen, deren Abbauprodukten und C-Peptid in Humanurin und Humanplasma zu Dopingkontrollzwecken mittels Flüssigkeitschromatographie / Massenspektrometrie, 2008; Dissertation Universität Bonn / Deutsche Sporthochschule Köln, http://hss.ulb.uni-bonn.de/2008/1433/1433.pdf